
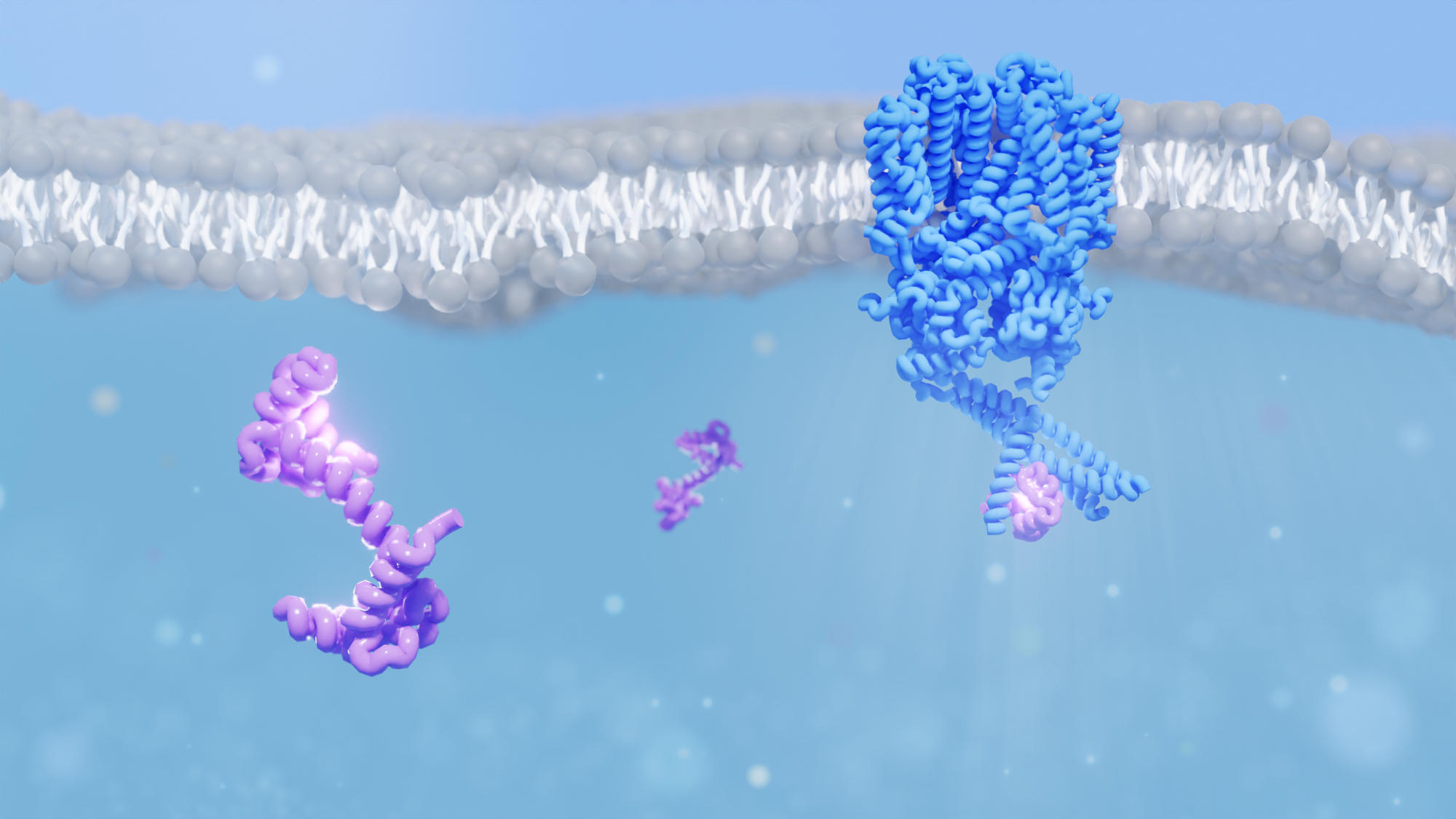
Les chercheurs ont décodé la structure du canal ionique à partir des cellules en bâtonnets de l’œil (représentées en bleu) lors de leur interaction avec la protéine caloduline (violette). Cette interaction est importante non seulement pour la fonction des canaux ioniques dans l’œil, mais également pour la fonction des canaux ioniques dans d’autres parties du corps telles que le cœur. Crédit : Institut Paul Scherrer/Dina Schuster
De nouvelles découvertes passionnantes ont mis en lumière l’interaction entre la protéine caloduline et un canal ionique dans l’œil, ce qui pourrait révéler le secret de la sensibilité exceptionnelle de nos yeux aux conditions de faible luminosité.
Grâce à la microscopie électronique cryogénique et à la spectrométrie de masse, une équipe de chercheurs du PSI a réussi à révéler la structure du canal ionique de l’œil où il interagit avec la protéine caloduline – un mystère qui intrigue les scientifiques depuis 30 ans. Cette réaction pourrait expliquer comment nos yeux peuvent atteindre une sensibilité aussi remarquable à la lumière tamisée. Les résultats ont été publiés dans la revue PNAS.
Lorsque vous regardez l’écran lumineux de votre téléphone ou de votre ordinateur, les canaux ioniques de vos yeux réagissent à la lumière en les fermant. Cette action représente l’aboutissement d’une réaction chimique en chaîne initiée par l’exposition à la lumière. De ce fait, les ions calcium ne peuvent plus traverser les canaux de la membrane cellulaire, ce qui conduit à la conversion du signal biochimique en signal électrique. Ce signal voyage ensuite à travers votre système nerveux, atteignant éventuellement votre cerveau pour être traité.
Le même processus se produit lorsque vous vous tenez dehors la nuit et que vous regardez le ciel. Maintenant, les cellules en bâtonnets font l’affaire. Ce sont ces cellules qui rendent nos yeux sensibles aux faibles niveaux de lumière, nous permettant de regarder le ciel nocturne et de détecter quelques photons de lumière d’une étoile lointaine. Nous tenons cela pour acquis, mais c’est un exploit incroyable.
Aujourd’hui, une équipe dirigée par le scientifique du PSI Jacopo Marino a amélioré notre compréhension de la façon dont une petite protéine appelée calmoduline aide à y parvenir, en interagissant avec les canaux ioniques des cellules en bâtonnets. La calmoduline est un capteur de calcium. Il permet à la cellule de répondre aux fluctuations du calcium – l’une des méthodes de communication universelles de la cellule. L’équipe, une collaboration entre des groupes du PSI, de l’ETH Zurich et de l’Université de Bonn, a élucidé la structure tridimensionnelle d’un canal ionique de nucléotide cyclique (CNG) qui se lie à la calmoduline.
Une fonction importante de la calmoduline dans l’œil
Il y a un an, des chercheurs ont réussi à déchiffrer la structure de ce même canal ionique, présent dans les bâtonnets de la rétine de la vache et identique au canal ionique présent dans les bâtonnets de nos yeux. Rod CNG se compose de quatre sous-unités, une structure commune à de nombreux autres canaux ioniques. Cependant, la particularité du canal est que trois sous-unités – appelées sous-unité A – sont identiques, tandis que la quatrième – sous-unité B – est différente.
Les scientifiques savent depuis longtemps que cette sous-unité lie la calmoduline. Dans tout le règne animal, cette caractéristique se retrouve. Cependant, la nature exacte de son rôle restait floue. « Si quelque chose a été préservé au cours de l’évolution, c’est une indication très forte que c’est important d’une certaine manière », explique Marino. « Nous savions que la calmoduline module l’activité du canal via la sous-unité B, mais le type de changements structurels qui se produisent est un grand mystère depuis une trentaine d’années, principalement parce que les gens n’ont pas été en mesure de résoudre la structure du canal ionique. »
Désormais, les chercheurs peuvent fournir une vue 3D de ce qui se passe réellement. Grâce à une combinaison de cryo-microscopie électronique et de spectrométrie de masse, ils ont pu noter que lorsque la calmoduline se lie, le canal ionique se resserre un peu.
Les chercheurs pensent que c’est la façon naturelle de fermer les canaux. Quel en serait le but ? « Nous pensons que c’est un moyen de réduire les ouvertures des conduits spontanés qui peuvent provoquer des bruits de fond afin que nos yeux soient sensibles à la faible luminosité », explique Marino.
La spectrométrie de masse aide les chercheurs à résoudre la structure en zigzag
Obtenir la structure de la calmoduline et ligaturer le canal ionique n’a pas été facile. L’interaction entre la calmoduline et Rod CNG a lieu dans une région hautement élastique du conduit, où il est libre d’osciller. En cryo-microscopie électronique, cela rend très difficile l’obtention d’informations structurelles à haute résolution. Ici, Marino propose une analogie : « Imaginez que vous avez une salle où des gens dansent. Vous prenez une photo et vous voulez en déduire la forme d’un corps humain. Vous pourriez être en mesure de dire à quoi ressemble une tête, mais avec des membres. en agitant partout, les jambes et les bras seront flous.
Grâce à une rencontre fortuite, l’équipe a pu repérer cette structure en dents de scie. doctorat L’étudiante Dina Schuster a écouté une présentation de Marino. « Nous nous préparions à publier uniquement sur la base des données de cryo-microscopie électronique, ce qui laissait une grande partie de la réaction ambiguë, lorsque Dina m’a approché et m’a dit » Je pense que je peux vous aider « », se souvient-il.
Schuster développe de nouvelles stratégies basées sur la spectrométrie de masse pour étudier les interactions protéiques. Ces techniques utilisent des enzymes pour couper les protéines en morceaux, soit dans des conditions natives dans des parties de la membrane rétinienne, soit lors d’une réticulation chimique. Les fragments de protéines, liés entre eux, sont identifiés par spectrométrie de masse. Cela a révélé des informations sur les parties de la protéine qui étaient proches les unes des autres dans un espace tridimensionnel, ce qui équivaut à reconstituer un puzzle en trois dimensions. « Ces techniques nous ont permis de réduire certaines possibilités qui étaient autrement obscures avec la cryo-microscopie électronique », explique Schuster, co-auteur principal de la publication avec la doctorante Diane Barrett.
Du miracle de la vision aux implications pour la santé humaine
La calmoduline régule les canaux ioniques non seulement dans les yeux mais dans tout le corps, contrôlant les signaux électriques essentiels au bon fonctionnement de divers muscles et organes. Ces dernières années, il est devenu clair que lorsque cette réaction tourne mal en raison de mutations du gène de la caloduline, il peut y avoir des effets graves sur la santé, comme l’insuffisance cardiaque : quelque chose qui n’est pas encore entièrement compris.
En plus de nous aider à comprendre l’une des merveilles fondamentales – comment nous pouvons voir les étoiles – les résultats de cette étude et les méthodes utilisées peuvent nous aider à comprendre l’interaction de la calmoduline avec les canaux ioniques dans d’autres parties du corps.
Référence : « Bases structurelles de la modification de la codoline du canal nucléotidique cyclique de la tige » par Diane C.A. Barrett, Dina Schuster, Matthew J. Rodrigues, Alexander Leitner, Paola Picotti, Gibbard FX Schertler, U. Benjamin Cobb, Volodymyr M. Korkov et Jacobo Marino, 3 avril 2023, disponible ici. Actes de l’Académie nationale des sciences.
DOI : 10.1073/pnas.2300309120





More Stories
Quelle est la prochaine grande nouveauté en matière de perte de poids ?
Une nouvelle découverte pourrait réécrire les livres sur la génétique
Compenser le sommeil le week-end pourrait réduire d’un cinquième le risque de maladie cardiaque – étude | Maladie cardiaque